

韶关市武江区云岭高考复读中心
地址:韶关市武江区沙湖路23号
办公电话:0751-8898186
李老师:17725819688
陈老师:19107516281
邮箱:sgylgf@126.com
沉淀滴定成为了近年来考试的热点问题。比如2018年全国新课标Ⅲ,第六题就考查了这部分内容。今天我就给大家讲解一下这部分知识。
1.概念
沉淀滴定是利用沉淀反应进行滴定、测量分析的方法。生成沉淀的反应很多,但符合条件的却很少,实际上应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-的浓度。
2.原理
沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液测定溶液中Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更难溶的缘故。
莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度.已知:

(1)滴定终点的现象是_ __.
(2)若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是________。
A.NaCl B.BaBr C.Na2CrO4
刚好达到滴定终点时,发生反应的离子方程式为______
分析:若用AgNO3去滴定NaSCN溶液,可选用的滴定指示剂的物质的溶解度应比AgSCN大,且现象明显,应为Na2CrO4,混合物中有砖红色沉淀生成,
答案:(1)滴入最后一滴标准溶液,生成砖红色沉淀
(2)C 2Ag++CrO42-===Ag2CrO4↓
我们再来看一看2018年的高考真题
6.(6分)用0.100 mol•L﹣1 AgNO3滴定50.0 mL0.0500 mol•L﹣1 Cl﹣溶液的滴定曲线如图所示。下列有关描述错误的是( )
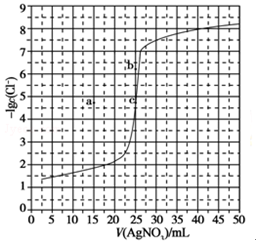
A.根据曲线数据计算可知Ksp(AgCl)的数量级为10﹣10
B.曲线上各点的溶液满足关系式c(Ag+)•c(Cl﹣)=Ksp(AgCl)
C.相同实验条件下,若改为0.0400mol•L﹣1 Cl﹣,反应终点c移到a
D.相同实验条件下,若改为0.0500 mol•L﹣1 Br﹣,反应终点c向b方向移动
分析:这是一道关于沉淀滴定曲线的试题,涉及曲线问题要找到关键点。那么哪些位置的点是关键点呢?一般情况下找起点,滴定终点。
A.沉淀滴定时到达滴定终点时曲线斜率突变,图中c点为滴定终点,此处﹣lgc(Cl﹣)=4.8,达到沉淀溶解平衡时,c(Ag+)=c(Cl﹣)=10﹣4.8mol/L,所以根据曲线数据计算可知Ksp(AgCl)=10﹣9.6Ksp(AgCl)的数量级为10﹣10,因此故A正确;
B.曲线上的点是沉淀溶解平衡的平衡点,Qc=c(Ag+)c(Cl﹣)=Ksp(AgCl),故B正确;
C.溶度积常数只随温度改变而改变,改变滴定反应液浓度不改变溶度积常数,所以相同实验条件下,若改为0.0400mol•L﹣1 Cl﹣,50x0.04=0.1x x=20则所需AgNO3溶液体积就变为=20mL,反应终点c应该移到横坐标对应的20ml的位置,故C错误;
D.AgBr比AgCl更难溶,Ksp(AgBr)
答案:C